Las intervenciones terapéuticas sobre la sarcopenia tiene como objetivo desarrollar la masa muscular mediante el aumento de la actividad física, la mejora de la nutrición y la optimización de la homeostasis hormonal. Hasta la fecha, el ejercicio sigue siendo la única terapia que ha mostrado verdadera eficacia.
La suplementación dietética parece ser beneficiosa solo cuando se combina con el ejercicio, y aunque el uso farmacológico de la vitamina D y la testosterona cuenta con evidencia de ensayos clínicos en humanos, aún no se han aprobado fármacos anti-sarcopénicos.
Ejercicio
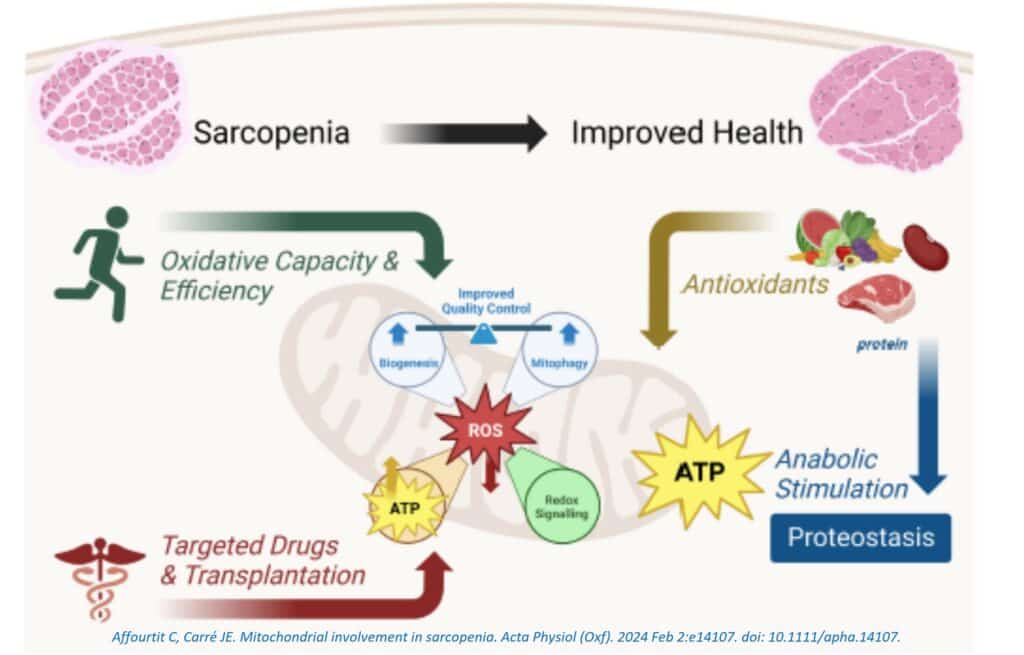
La actividad física aumenta el consumo de ATP por parte de las células musculares esqueléticas para alimentar la contracción. La consiguiente disminución de la carga energética miocelular desencadena la quinasa activada por AMP (AMPK), un regulador clave del metabolismo energético celular que ayuda a ajustar el suministro de ATP para satisfacer la demanda de ATP. Además, la actividad física estimula agudamente la producción de ROS por parte de las mitocondrias del músculo esquelético y, por lo tanto, causa un leve estrés oxidativo endógeno que activa aún más la AMPK.
El ejercicio protege contra el estrés oxidativo a largo plazo, ya que las células musculares esqueléticas aumentan la expresión de sistemas de defensa antioxidante en respuesta al aumento agudo de ROS. Esta respuesta mitohormética probablemente contribuya a los beneficios de la actividad física para la actividad mitocondrial en el músculo esquelético envejecido. Los efectos positivos a largo plazo del ejercicio incluyen una capacidad oxidativa mejorada, con evidencia de un aumento en la capacidad de síntesis de ATP in vivo y de una mayor actividad de los complejos respiratorios mitocondriales ex vivo. Relacionado con este beneficio oxidativo, el ejercicio aumenta la biogénesis mitocondrial y la masa mitocondrial, y mejora el control de calidad mitocondrial a través de efectos en la dinámica estructural y la autofagia.
Con ROS como importante culpable de los defectos mitocondriales en el músculo sarcopénico, tal vez no sea sorprendente que el ejercicio rescate tales defectos, ya que fortalece la defensa antioxidante de las células. Sin embargo, es interesante destacar que los aumentos inducidos por el ejercicio en la masa muscular y la función muscular no siempre implican un aumento de la capacidad oxidativa, ya que la naturaleza de los efectos mitocondriales parece depender del tipo de ejercicio. Tanto el entrenamiento de resistencia aeróbica como el de fuerza aumentan la calidad del músculo esquelético en la sarcopenia, pero mientras que el beneficio del ejercicio de resistencia aeróbica está consistentemente vinculado a una clara estimulación de la biogénesis mitocondrial y un aumento de la capacidad oxidativa, los efectos mitocondriales del ejercicio de fuerza son menos claros. El entrenamiento de fuerza no afecta la biogénesis mitocondrial o el contenido mitocondrial, pero sí altera la función mitocondrial intrínseca. Por ejemplo, el ejercicio de fuerza cambia el transcriptoma mitocondrial y aumenta la abundancia específica de complejos respiratorios mitocondriales, lo cual es consistente con la observación de que el ejercicio de fuerza aumenta la capacidad de síntesis de ATP sin cambiar el contenido mitocondrial, y puede indicar una mayor eficiencia de acoplamiento de la fosforilación oxidativa.
La AMPK se activa durante el ejercicio por una disminución de la relación ATP/AMP y por niveles elevados de ROS. Las fibras musculares esqueléticas demandan mucho ATP durante tanto el ejercicio de resistencia aeróbica como el de fuerza y aumentan su producción de ROS en respuesta aguda a ambos tipos de actividad física. Los diferentes efectos mitocondriales del entrenamiento de resistencia aeróbica y de fuerza no están relacionados con estas señales celulares per se, sino que es más probable que se deban al reclutamiento diferencial de tipos de fibras durante los diferentes tipos de ejercicio. El ejercicio de fuerza se centra principalmente en las fibras tipo 2 de contracción rápida, que obtienen más ATP de la glucólisis que sus contrapartes tipo 1 de contracción lenta. El tipo de ejercicio parece dictar qué tipo de fibra muscular esquelética contribuye más al aumento de la masa muscular y la función provocados por la actividad física. El entrenamiento de resistencia aeróbica induce la formación de fibras tipo 1, lo que se refleja en un aumento de la masa mitocondrial, mientras que el entrenamiento de fuerza no aumenta la masa mitocondrial en las fibras recién formadas tipo 2, pero mejora la eficiencia de síntesis de ATP mitocondrial. Es importante destacar que el ejercicio de fuerza amplifica el aumento en la capacidad oxidativa mitocondrial del músculo esquelético sarcopénico establecido por el ejercicio de resistencia aeróbica. La capacidad del músculo envejecido para aumentar la masa mitocondrial en respuesta al ejercicio de resistencia aeróbica indica que los mecanismos que regulan la capacidad funcional mitocondrial permanecen intactos en las personas mayores. Si esto también es válido para la sarcopenia secundaria que se desarrolla en enfermedades es menos claro. Por ejemplo, mientras que el nivel de transcripción de la coactivadora-1α del receptor activado por proliferadores de peroxisomas-γ aumenta en individuos no dializados con enfermedad renal crónica después de 12 semanas de actividad física aeróbica, la masa mitocondrial parece no verse afectada.
Nutrición
La nutrición adecuada es un aspecto esencial del manejo actual de la sarcopenia. Se han explorado muchos suplementos dietéticos, incluyendo macronutrientes y micronutrientes como proteínas, lípidos insaturados y vitaminas, así como una variedad de polifenoles de fuentes naturales. Sin embargo, es importante destacar que el soporte nutricional generalmente solo es efectivo en combinación con el ejercicio. Los beneficios de los polifenoles, la vitamina D y los ácidos grasos poliinsaturados pueden estar relacionados con las propiedades antioxidantes de estos nutrientes, pero no está claro en qué medida su uso como suplementos dietéticos afecta realmente la producción de ROS mitocondriales en el músculo sarcopénico.
La relación bioenergética entre la proteína dietética y la actividad mitocondrial es dual, ya que los aminoácidos, específicamente la leucina, son combustibles metabólicos oxidativos que permiten la síntesis de ATP cuando se descomponen mediante el catabolismo oxidativo, así como estimulantes anabólicos de la síntesis de proteínas, provocando el consumo de ATP. La suplementación de proteínas sigue siendo fundamental en el manejo nutricional de la sarcopenia primaria y secundaria, lo cual no es sorprendente dado que la proteostasis perturbada es una característica clave de este trastorno muscular.
Con el envejecimiento, la síntesis de proteínas musculares pierde sensibilidad a estímulos anabólicos como los aminoácidos esenciales de la dieta, y esta resistencia anabólica perturba la proteostasis junto con la pérdida de la inhibición de la insulina sobre la degradación de proteínas. Los suplementos de proteínas buscan superar la resistencia anabólica, pero tienen beneficios limitados por sí mismos, ya que parecen ser más beneficiosos cuando se administran junto con el ejercicio. Esto sugiere que tanto los estímulos catabólicos como los anabólicos son necesarios para restaurar la masa y la función del músculo esquelético en la sarcopenia.
La leucina, en particular, se ha reconocido por agregar ‘valor biológico’ a los suplementos de aminoácidos esenciales y proteínas, ya que parece estimular tanto procesos anabólicos como catabólicos. En el músculo esquelético sano, la leucina aumenta agudamente la síntesis de proteínas en el estado postprandial a través de la activación de mTOR por varias señales, incluyendo acetil CoA, leucil-ARNt y sestrina. Además, estudios preclínicos en roedores sugieren que la leucina también desencadena una respuesta catabólica adaptativa que involucra AMPK, aumentando la biogénesis mitocondrial, el contenido de ADN mitocondrial, la oxidación de ácidos grasos y la captación de glucosa. La ocurrencia aparentemente paralela de estímulos catabólicos y anabólicos es compleja y paradójica, ya que AMPK es un desactivador bien establecido de mTORC1. Las respuestas catabólicas y anabólicas inducidas por la leucina probablemente estén separadas temporal y espacialmente, a través de la participación de diferentes tipos de fibras.
La proteína contribuye al 10%-15% de la oxidación total de combustible en el estado postabsortivo en el músculo esquelético en reposo, y la catabolización de aminoácidos de cadena ramificada representa aproximadamente dos tercios de esta contribución. La inhibición de la insulina sobre la degradación de proteínas se pierde en el músculo sarcopénico, lo que probablemente aumenta la catabolización oxidativa de aminoácidos de cadena ramificada en individuos mayores. La oxidación sistémica de estos aminoácidos ocurre predominantemente en las mitocondrias del músculo esquelético, y la tasa de oxidación es sensible a cambios en la concentración intramuscular de aminoácidos de cadena ramificada relacionados con la nutrición. La tasa de oxidación de aminoácidos de cadena ramificada en personas mayores también se ve aumentada por el ejercicio de resistencia y resistencia, al igual que la respuesta anabólica a la leucina, sugiriendo nuevamente que tanto los estímulos anabólicos como catabólicos son necesarios para obtener el máximo beneficio de la nutrición en la sarcopenia.
La idea de que la suplementación de proteínas es más efectiva para el manejo de la sarcopenia cuando se combina con la actividad física sugiere que los procesos bioenergéticos desencadenados por la demanda de energía deben estar activos para obtener el máximo beneficio de los estímulos anabólicos. Los aminoácidos suplementados pueden ser útiles como combustible catabólico para la síntesis de ATP solo si se estimula la demanda de ATP, por ejemplo, mediante el ejercicio. Es importante enfatizar que un aumento en la ingesta de macronutrientes sin aumentar el gasto energético puede hacer más daño que bien, ya que dicha ingesta se espera que cree un entorno celular excesivamente reducido que promueva la generación de ROS. En este sentido, la resistencia a la insulina en el músculo esquelético relacionada con la obesidad surge al menos en parte debido a desequilibrios en la bioenergética que aumentan los niveles patológicos de ROS. Además, la pérdida de la sensibilidad a la insulina en el músculo esquelético es una característica temprana de la sarcopenia urémica. Nutrientes con fuertes propiedades antioxidantes pueden proteger contra niveles excesivamente altos de ROS, pero pueden inadvertidamente atenuar cualquier beneficio adaptativo hormético del ejercicio que dependa de un aumento agudo en la producción de ROS.
Intervención farmacológica
Hasta la fecha, no se han aprobado fármacos anti-sarcopénicos, ya que hay un apoyo insuficiente de ensayos clínicos en humanos para justificar intervenciones farmacológicas en la práctica clínica, aparte de la vitamina D en mujeres mayores y la testosterona en hombres mayores. La vitamina D es un ejemplo de ‘Alimentos para Fines Médicos Especiales’ y, a veces se denomina nutracéutico. A pesar de la falta de evidencia de ensayos clínicos, se han sugerido numerosos enfoques farmacológicos. Se han investigado medicamentos que incluyen testosterona, derivados de testosterona (melatonina) y moduladores selectivos de los receptores de andrógenos o SARMS, que no solo aumentan el número de células satélite del músculo esquelético, sino que también tienen efectos beneficiosos en las fibras musculares en sí. Otros ejemplos de medicamentos que se han explorado incluyen anticuerpos inhibidores contra citoquinas proinflamatorias y inhibidores de la miostatina. Terapias vinculadas explícitamente a la función mitocondrial incluyen la reposición de la hormona del crecimiento, la ghrelina y los agonistas del receptor de la ghrelina, y el ácido 5-aminolevulínico.
La notable falta de aprobación de medicamentos probablemente esté relacionada con la limitada cantidad de ensayos clínicos aleatorizados, que generalmente se ven obstaculizados por la variedad de definiciones de sarcopenia y la dificultad para identificar puntos finales primarios. Otras aproximaciones terapéuticas son muy buscadas, y las mitocondrias han atraído mucha atención en este sentido.
La medicina mitocondrial es un campo en desarrollo rápido, y las estrategias para administrar fármacos dirigidos a las mitocondrias han sido revisadas recientemente por otros. El ejercicio ha sido reconocido como una ‘medicina natural’ para las mitocondrias del músculo esquelético, pero puede ser posible en el futuro mejorar la actividad de estos orgánulos en el músculo sarcopénico con fármacos dirigidos. Los medicamentos que se entregan de manera pasiva o activa a las mitocondrias del músculo esquelético tienen el potencial de preservar la calidad y funcionalidad mitocondrial al reducir el estrés oxidativo. Aunque aún en sus primeras etapas, varios estudios preclínicos han ofrecido pruebas de concepto para este enfoque terapéutico potencial. Por ejemplo, MitoQ y MitoTEMPOL, que son antioxidantes dirigidos a las mitocondrias y miméticos de la superóxido dismutasa, respectivamente, han demostrado mejorar la fuerza y masa muscular al alterar la bioenergética en varios modelos de ratones con enfermedades. Mientras tanto, el péptido SS31 dirigido a las mitocondrias ha demostrado aumentar la tolerancia al ejercicio en ratones ancianos.
El trasplante mitocondrial es un enfoque terapéutico con mucho potencial, pero también está en sus primeras etapas. Se ha probado la introducción de mitocondrias saludables en células o tejidos disfuncionales para aumentar la capacidad oxidativa en diversos contextos de enfermedades, mientras que el trabajo con modelos celulares y animales sugiere que el enfoque puede ayudar a combatir la atrofia muscular.
Acceso libre al artículo original en: https://www.fisiologiadelejercicio.com/wp-content/uploads/2024/02/Mitochondrial-involvement-in-sarcopenia.pdf
Referencia completa:
Affourtit C, Carré JE. Mitochondrial involvement in sarcopenia. Acta Physiol (Oxf). 2024 Feb 2:e14107. doi: 10.1111/apha.14107.