La disminución dependiente de la edad en la capacidad aeróbica coincide con cambios en el metabolismo energético del músculo esquelético, y la disfunción mitocondrial se ha identificado como un rasgo distintivo del envejecimiento.
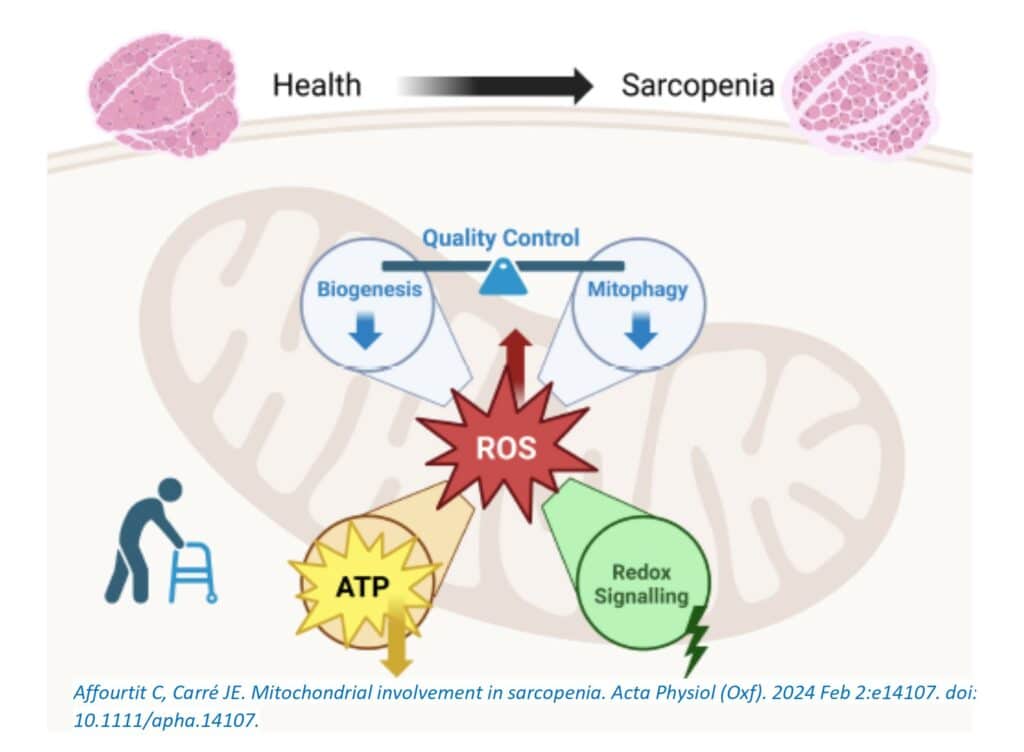
La sarcopenia parece estar inevitablemente vinculada al estrés oxidativo (Figura 1), una condición patológica unificadora que es al menos parcialmente responsable de la comprometida regulación de calidad mitocondrial, la bioenergética mitocondrial y la biología redox mitocondrial en el músculo sarcopénico.
Biología redox mitocondrial
El estrés oxidativo resulta de una disminución en la expresión de sistemas de defensa antioxidante y del aumento en la formación de especies reactivas de oxígeno (ROS), que en gran medida se atribuye a las mitocondrias. Niveles elevados de ROS interfieren con la biología redox mitocondrial, que contribuye a la regulación fisiológica de la insulina y otras vías de señalización anabólica, inhibiendo así la síntesis de proteínas. La perturbación consiguiente de la proteostasis se agrava por los efectos estimulantes de los niveles altos de ROS en la proteólisis: la oxidación de las proteínas por ROS las hace más susceptibles a la degradación mediada por el proteasoma, al menos en parte, porque la oxidación provoca el desplegamiento. El aumento de la autofagia a través de la prevención por ROS de la activación de mTORC1, así como la expresión inducida por ROS de proteasas activadas por calcio, inclinan aún más el equilibrio de la proteostasis hacia la pérdida de proteínas. Por lo tanto, los ROS provocan la disfunción y atrofia del músculo esquelético, y estudios clínicos han demostrado que el daño oxidativo aumenta con la edad y está asociado con la disminución de la fuerza muscular. El estrés oxidativo que lleva a la sarcopenia durante el envejecimiento, la inactividad y enfermedades crónicas probablemente esté relacionado con un estado persistente de inflamación sistémica de bajo grado, en el cual la producción de ROS se estimula por citoquinas proinflamatorias. Las condiciones en las que se desarrolla la sarcopenia se caracterizan además por un desequilibrio bioenergético perturbado, donde la disponibilidad de nutrientes en las células musculares supera al gasto energético, y el catabolismo de nutrientes crea un entorno celular reducido que permite la generación de ROS. Es probable que los ROS exacerben la inflamación y refuercen así su propia formación. Prevenir que los niveles de ROS en el tejido muscular se vuelvan demasiado altos parece ser una opción terapéutica atractiva para combatir la sarcopenia, y ciertas intervenciones nutricionales y farmacológicas dirigidas a las mitocondrias tienen, de hecho, una justificación antioxidante. Sin embargo, las terapias basadas en antioxidantes podrían ser contraproducentes, ya que la insulina y las vías de señalización anabólica cruciales para la proteostasis se regulan fisiológicamente por ROS. Debido a esta dualidad de los ROS, se ha cuestionado la promesa antisarcopénica de las terapias basadas en antioxidantes. Las futuras intervenciones basadas en antioxidantes probablemente se beneficiarán de una comprensión más completa de la biología redox mitocondrial y de una comprensión más detallada de la naturaleza molecular y el origen de los ROS responsables del cambio progresivo hacia el estrés oxidativo que es evidente a medida que se desarrolla la sarcopenia primaria y secundaria.
Control de calidad mitocondrial
La biogénesis mitocondrial, la mitofagia y la dinámica estructural son importantes para el control de calidad mitocondrial, ya que estos procesos mantienen la capacidad funcional, eliminan orgánulos redundantes o disfuncionales y remodelan la morfología del orgánulo, respectivamente. La regulación de estos procesos se ve interrumpida tanto en el músculo esquelético sarcopénico primario como en el secundario, al menos en parte debido al estrés oxidativo, de modo que la capacidad miocelular para reemplazar mitocondrias disfuncionales con mitocondrias funcionales se ve reducida. La capacidad funcional también depende de la regulación de la alta variabilidad en la renovación de proteínas mitocondriales individuales, que puede cambiar en el músculo esquelético en envejecimiento. El control de calidad comprometido de las mitocondrias probablemente contribuye a la disminución de la capacidad oxidativa del músculo sarcopénico, aunque también es posible que los signos moleculares de la biogénesis mitocondrial atenuada reflejen una demanda reducida de capacidad oxidativa. Es posible, por ejemplo, que la resistencia anabólica de la síntesis de proteínas disminuya el gasto total de energía, lo que se espera que disminuya la síntesis de ATP oxidativo dado que el control del metabolismo energético del músculo esquelético es impulsado por la demanda y dado que una proporción significativa del suministro total de ATP del músculo (aproximadamente el 20%) se destina generalmente a la síntesis de proteínas. En este sentido, vale la pena destacar que las intervenciones terapéuticas destinadas a aumentar la capacidad oxidativa a través de una mejor biogénesis mitocondrial tendrían un éxito limitado si la demanda de dicha capacidad aumentada permaneciera baja.
Bioenergética mitocondrial
La bioenergética del músculo esquelético ha sido investigada extensamente en humanos con espectroscopia de resonancia magnética de fósforo-31 (31P MRS). Por ejemplo, las mediciones in vivo de la velocidad con la que se recupera la fosfocreatina (PCr) después del ejercicio han proporcionado mucha información sobre la capacidad de la fosforilación oxidativa en individuos sanos, así como en personas que viven con enfermedades crónicas. De hecho, la 31P MRS estableció relativamente pronto que la velocidad de recuperación de PCr del músculo esquelético disminuye con la edad, a medida que se desarrolla la sarcopenia. La sarcopenia secundaria también se asocia con tasas de recuperación de PCr disminuidas, como se revela, por ejemplo, en pacientes con enfermedad renal crónica dependiente de diálisis, enfermedad pulmonar crónica, trastornos tiroideos e insuficiencia cardíaca. Estas observaciones (fisiopatológicas) están respaldadas por estudios en biopsias de músculo esquelético humano que también demuestran un descenso dependiente de la edad en la velocidad de recuperación de PCr después del ejercicio. Por lo tanto, los datos in vivo y ex vivo sugieren fuertemente que la capacidad de síntesis de ATP oxidativo del músculo esquelético sarcopénico es menor que la del músculo sano. La manipulación perturbada del calcio en el músculo sarcopénico puede desregular aún más el metabolismo oxidativo. Es importante destacar que los efectos de la edad en la capacidad oxidativa siguen siendo generalmente heterogéneos. La actividad física habitual variable, así como el sexo de los individuos estudiados, contribuyen a esta heterogeneidad, al igual que la variedad de grupos musculares examinados; estas variables deben tenerse en cuenta al interpretar los efectos de la edad en la síntesis mitocondrial de ATP. Es importante destacar que la edad no solo disminuye la capacidad de la fosforilación oxidativa del músculo esquelético, sino también la eficiencia con la que la respiración mitocondrial y la síntesis de ATP están acopladas.
Las mediciones de recuperación de PCr después del ejercicio siguen siendo, sin duda, la forma más fiable, aunque indirecta, de cuantificar el suministro mitocondrial de ATP oxidativo en humanos, pero la información obtenida se limita a la capacidad bioenergética y ofrece una comprensión limitada de la actividad de síntesis de ATP en condiciones de demanda de energía variable. En este sentido, es digno de destacar que la relación causal entre la disminución de la capacidad oxidativa y la alteración de la proteostasis en el músculo esquelético envejecido sigue siendo incierta. Existe la argumentación, ya sea explícita o implícitamente, de que la tasa de síntesis de proteínas disminuye en la sarcopenia porque las mitocondrias disfuncionales no pueden sostener suficientemente este y otros procesos anabólicos desde el punto de vista energético, pero también es concebible que la capacidad disminuida de fosforilación oxidativa sea una adaptación a la menor demanda de ATP derivada del deprimido anabolismo que resulta de la resistencia a la insulina y anabólica.
Acceso libre al artículo original en: https://www.fisiologiadelejercicio.com/wp-content/uploads/2024/02/Mitochondrial-involvement-in-sarcopenia.pdf
Referencia completa:
Affourtit C, Carré JE. Mitochondrial involvement in sarcopenia. Acta Physiol (Oxf). 2024 Feb 2:e14107. doi: 10.1111/apha.14107.