Os presentamos una investigación de Ortiz et al., (2023) y que os presentamos a continuación.
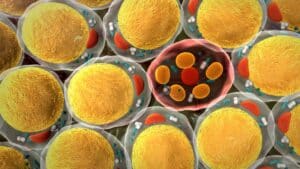
Los mamíferos tienen dos tipos principales de tejido adiposo: el tejido adiposo blanco (WAT) y el tejido adiposo pardo (BAT). Aunque el WAT funciona como un tejido de almacenamiento de energía debido a su alto contenido de triglicéridos en una gran gota de grasa y su bajo número relativo de mitocondrias, el BAT es un tejido con una menor cantidad de triglicéridos dispuestos en varias pequeñas gotas de grasa, pero con un mayor número de mitocondrias que presentan la proteína desacoplante 1 (UCP-1), que se considera el marcador principal del BAT y es en parte responsable de su función termogénica.
Suscríbete para acceder a +50 formaciones
Un tercer tipo de tejido adiposo llamado tejido adiposo beige comparte similitudes funcionales y morfológicas con el BAT y puede activarse a partir de los adipocitos blancos cuando se exponen a estímulos específicos como temperaturas frías y ejercicio físico, para realizar funciones similares a los adipocitos marrones. Aunque el BAT y el tejido adiposo beige presentan diferencias, como su origen en diferentes líneas celulares, esta revisión se centrará en sus funcionalidades similares. Por lo tanto, en este documento nos referiremos a estos tejidos colectivamente como BAT.
La activación de estos tejidos adiposos se ha propuesto como un objetivo terapéutico en el tratamiento de la obesidad y las enfermedades asociadas debido a sus funciones termogénicas. Cuando se activan, estos tejidos aumentan la oxidación de los sustratos de energía para mantener la termogénesis, lo que conduce a una mayor utilización de ácidos grasos y glucosa, disminuyendo la resistencia a la insulina y promoviendo la homeostasis energética. Sin embargo, la literatura científica ha demostrado recientemente que los efectos metabólicos promovidos por el BAT no se limitan a la termogénesis. Al igual que el WAT y el músculo esquelético, el BAT también libera factores de secreción, conocidos como batocinas. Estas moléculas, que pueden ser péptidos, lípidos o miARN, pueden actuar de manera autocrina y paracrina, apoyando la expansión y la activación del tejido, o de manera endocrina, llegando a varios tejidos diana, como el hígado, el corazón, el músculo esquelético y el WAT.
En estos tejidos, desempeñan importantes funciones en la prevención de la esteatosis hepática, la reducción de la resistencia a la insulina, la provisión de efectos cardioprotectores, la promoción del desarrollo muscular y la inducción de la browning del WAT, entre otros beneficios metabólicos.
La evidencia en animales y humanos demuestra que el ejercicio físico puede activar los tejidos termogénicos mediante dos posibles mecanismos de acción: 1) a través de la activación β-adrenérgica y 2) a través de la señalización de miocinas liberadas por el músculo esquelético en respuesta al ejercicio, como la irisina, la interleucina 6 (IL6), la proteína similar a meteorina (METRNL), el lactato y el factor de crecimiento endotelial vascular A (VEGFA).
La activación de los tejidos termogénicos a través del ejercicio físico implica el reclutamiento de adipocitos maduros y otros tipos de células residentes en estos tejidos, como células progenitoras, células madre, células endoteliales, neuronales, hematopoyéticas e inmunitarias, que colectivamente promueven la remodelación del tejido adiposo, lo que conduce a una mayor actividad termogénica y/o secretora.
La acción autocrina y paracrina de las batocinas actúa de manera similar en las células residentes del tejido adiposo, promoviendo la angiogénesis, el crecimiento de nervios, la modulación del perfil de células del sistema inmunitario y la biogénesis de adipocitos. Esta remodelación crea un microambiente que favorece la expansión y activación del tejido adiposo pardo o beige. Algunas citocinas destacadas incluyen neuregulina 4 (NRG4), factor de crecimiento nervioso (NGF), proteína morfogenética ósea 8 b (BMP8b), VEGFA, ligando quimioquina 14 (CXCL14) e IL6.
Aunque la evidencia sobre la activación de la termogénesis en el BAT mediante el ejercicio físico no es completamente concluyente, la función secretora de estos tejidos ya ha sido demostrada en condiciones termoneutrales. Por lo tanto, algunos autores sugieren que este tejido no necesariamente necesita llevar a cabo la termogénesis para promover impactos positivos en la salud, ya que las batocinas tienen un gran potencial para promover la salud metabólica, principalmente en el control de la obesidad y la diabetes tipo 2.
La mayoría de la evidencia sobre el potencial del ejercicio para reclutar adipocitos termogénicos se centra en el aumento de la expresión de genes y proteínas relacionadas con la función termogénica y marcadores de oxidación de lípidos o glucosa. Al mismo tiempo, pocos estudios en humanos han investigado su función secretora en respuesta al ejercicio.
Esta revisión presenta una visión general de la influencia del ejercicio físico en la función secretora de los tejidos termogénicos. Además, recopila estudios clínicos que exploran los efectos del ejercicio físico en la función termogénica de estos tejidos y describe el papel del ejercicio y las batocinas en la remodelación del tejido adiposo blanco y pardo.
EL PAPEL DE LA TERMOGÉNESIS EN LA SALUD METABÓLICA
Debido a su función termogénica principal, cuando se activa, el BAT aumenta la oxidación de los sustratos de energía para mantener la termogénesis, lo que conduce a una mayor oxidación de ácidos grasos y glucosa, una reducción de la resistencia a la insulina y un aumento en el gasto energético.
Se estima que solo 50 g de BAT pueden representar alrededor del 20% del gasto energético diario cuando están completamente activados, aunque la contribución de la termogénesis del BAT al gasto energético muestra una alta variabilidad individual y parece ser menor en individuos con un índice de masa corporal (IMC) más alto.
La termogénesis está mediada principalmente por las proteínas UCP-1, que se encuentran en la membrana interna de las mitocondrias. Estas proteínas interrumpen el proceso de fosforilación oxidativa, permitiendo la fuga de iones de hidrógeno desde el espacio intermembrana hasta la matriz mitocondrial, generando calor. Por lo tanto, es un proceso en el que se gasta energía química para producir energía térmica.
Existe una fuerte correlación entre la prevalencia de la activación del BAT y el índice de masa corporal. A pesar de la correlación robusta, es importante destacar la posibilidad de que la relación pueda estar influenciada por efectos de confusión que necesitan ser mejor elucidados. A pesar de los desafíos para comprender cuál factor es la causa y cuál es el efecto, hay evidencia consistente de que la termogénesis del BAT contribuye a la homeostasis energética.
Hamann et al. desarrollaron un modelo de ratón transgénico con la capacidad de eliminar células UCP-1 positivas. Cuando a estos ratones se les dio una dieta alta en grasas, experimentaron un balance energético positivo y ganaron grasa. Al mismo tiempo, los animales con tejido termogénico activado estuvieron protegidos contra el aumento de peso, incluso cuando se les dio la misma dieta.
Estudios observacionales proporcionan evidencia que sugiere un papel importante de la activación del BAT más allá de la regulación energética. Becher et al. llevaron a cabo un análisis retrospectivo de diversas exploraciones de tomografía por emisión de positrones/tomografía computarizada (FDG-PET/CT) para detectar el BAT, y la cantidad de este tejido se asoció de manera independiente con una menor probabilidad de enfermedades cardiovasculares como la enfermedad coronaria, hipertensión, insuficiencia cardíaca y dislipidemias.
A pesar de la reducción de la actividad en personas obesas, algunos estudios en humanos han observado mejoras metabólicas con la activación del BAT a través de la exposición al frío en esta población. Hanssen et al. llevaron a cabo un estudio en hombres con sobrepeso expuestos al frío. Los autores observaron un aumento en la captación de glucosa por el BAT mediante FDG-PET/CT y mejoras clínicamente relevantes en la sensibilidad a la insulina.
Además de la exposición al frío, los fármacos agonistas de los receptores β-adrenérgicos también demostraron el mismo efecto en hombres obesos, mejorando la hemoglobina glucosilada, la tolerancia a la glucosa oral, la sensibilidad a la insulina y promoviendo el “browning” del tejido adiposo subcutáneo.
El enfoque farmacológico utilizando agonistas adrenérgicos, aunque es efectivo en la activación del tejido termogénico, no proporciona selectividad solo a los receptores de adipocitos β-3-adrenérgicos, lo que conlleva efectos secundarios como la taquicardia, lo que hace que su seguridad a largo plazo sea discutible.
La exposición al frío, aunque es efectiva, no es eficiente debido a su falta de sostenibilidad, ya que la retirada del estímulo parece interrumpir la actividad termogénica del BAT.
Dado lo anterior, se vuelve relevante profundizar en nuestra comprensión de intervenciones con el potencial de activar el BAT de manera segura y sostenible. En esta revisión, presentamos una discusión exhaustiva sobre el papel del ejercicio físico como una intervención para la activación del BAT.
ACTIVACIÓN DE TEJIDOS TERMOGÉNICOS EN RESPUESTA A LAS MIOCINAS INDUCIDAS POR EL EJERCICIO FÍSICO
El ejercicio físico promueve beneficios para la salud sistémica. En parte, estos beneficios son mediados por factores de secreción liberados por el músculo en respuesta al ejercicio físico, llamados miocinas. Además de actuar de manera autocrina y paracrina en el músculo esquelético, estas proteínas se liberan en la sangre en respuesta a la actividad contráctil del músculo, llegando a múltiples órganos, incluido el tejido adiposo.
En el tejido adiposo blanco (WAT), las miocinas promueven el desarrollo de adipocitos beige, un proceso llamado “browning” del WAT, en el cual los adipocitos blancos adquieren temporalmente el fenotipo y la funcionalidad de un adipocito marrón. Este tema está siendo ampliamente estudiado en la literatura científica.
El “browning” del tejido adiposo implica cambios morfológicos en los adipocitos blancos, que incluyen el desarrollo de más mitocondrias ricas en UCP-1 y un menor contenido de lípidos, dispuestos en múltiples gotas de grasa. Este proceso también conlleva cambios en la expresión génica, con un aumento en la expresión de genes termogénicos como los receptores activados por los proliferadores de peroxisomas c (PPARc), el coactivador transcripcional peroxisoma proliferador activado receptor-gamma coactivador 1 a (PGC-1 a), PR dominio que contiene 16 (PRDM16), la proteína de muerte celular CIDE-A (CIDEA) y UCP-1.
Bostrom et al. identificaron en ratones que al activar el PGC-1α en el músculo esquelético, se incrementa la expresión de una proteína de membrana llamada FNDC5, y cuando se escinde, da origen a una hormona llamada irisina. Los niveles plasmáticos de esta hormona parecen aumentar en humanos y ratones en respuesta al ejercicio y también parece tener acciones en el “browning” del WAT.
Rao et al. observaron el mismo efecto en el WAT para la miocina METRNL, que parece inducir genes termogénicos y antiinflamatorios en el WAT a través de la estimulación de la interleucina 4 (IL4), que modula la activación de macrófagos antiinflamatorios en el WAT, un proceso que favorece el desarrollo de un fenotipo beige.
De manera similar, Knudsen et al. identificaron que el aumento en la expresión de UCP-1 en el WAT de ratones en respuesta al ejercicio depende de la miocina IL6, como también observó Carriere et al., quien también observó una regulación al alza de genes termogénicos (UCP-1, CIDEA) en respuesta al lactato, un metabolito liberado en la sangre en respuesta al ejercicio de alta intensidad.
Los animales tratados con una infusión intramuscular de lactato a concentraciones similares a las liberadas en respuesta al ejercicio mostraron adaptaciones en el WAT que se asemejan a las características del tejido termogénico. Estas adaptaciones incluyeron la regulación al alza de proteínas involucradas en la lipólisis, como la proteína quinasa activada por la adenosina monofosfato (AMPK) y la lipasa sensible a hormonas (HSL).
Además, hubo un aumento en los biomarcadores mitocondriales como PGC-1 a, a través de la activación de la proteína quinasa A (PKA), y un aumento en los receptores b-3-adrenérgicos.
ACTIVACIÓN DEL TEJIDO TERMOGÉNICO EN RESPUESTA A LA ESTIMULACIÓN β-ADRENÉRGICA DURANTE EL EJERCICIO
Además de estimular miocinas y metabolitos, el ejercicio físico también puede activar tejidos termogénicos a través de la activación β-adrenérgica. Este mecanismo de acción está mediado por la noradrenalina, que se une a los receptores β-3-adrenérgicos en los adipocitos y estimula el monofosfato de adenosina cíclico (cAMP), que fosforila la PKA y señala la regulación de la expresión del gen UCP-1, así como conduce a la lipólisis de los triglicéridos almacenados para mantener la termogénesis.
En cuanto a la activación del BAT en respuesta al ejercicio, hay menos estudios en humanos disponibles en la literatura que en animales. Aunque es posible encontrar resultados similares a los estudios en animales basados en la evidencia existente, los hallazgos de los estudios en humanos muestran una considerable diversidad. Esta variabilidad podría atribuirse a la heterogeneidad en las metodologías de investigación, las características de las poblaciones estudiadas, las variaciones en el tipo, intensidad y duración de los programas de ejercicio, así como diferentes enfoques empleados para evaluar el “browning” de tejidos.
Aunque la recopilación de evidencia demuestra que el ejercicio es una herramienta posible para promover el fenotipo beige en WAT, se necesitan más estudios en humanos para elucidar mejor este asunto en diferentes modalidades de ejercicio y poblaciones. A pesar de las limitaciones y los resultados contradictorios sobre la activación de la termogénesis en BAT, la literatura ya ha demostrado que el ejercicio físico puede activar otra función en este tejido, que se describirá a continuación.
EJERCICIO FÍSICO Y LA SECRECIÓN DE BATOCINAS
A pesar de que algunos estudios en animales y humanos no encuentran actividad termogénica influenciada por el ejercicio en el BAT, la evidencia emergente demuestra que los efectos sobre su función secretora no siguen el mismo patrón. Recientemente, se descubrió una lipocina (un factor de secreción de la clase de lípidos) llamada 12,13-diHOME, un metabolito del ácido linoleico liberado por el BAT en respuesta al ejercicio físico, que actúa principalmente en el músculo esquelético, aumentando la oxidación de ácidos grasos en este tejido.
Stanford et al. realizaron cromatografía líquida-espectrometría de masas (LC-MS) e identificaron que un episodio agudo de ejercicio físico aumentó los niveles plasmáticos de 12,13-diHOME en humanos, independientemente del género, edad, IMC o nivel de condición física. Este hallazgo se obtuvo a partir de dos cohortes diferentes con poblaciones diversas que realizaron ejercicio aeróbico moderado a intenso para evaluar los niveles circulantes de un panel de 88 lípidos. De todos estos lípidos, solo los niveles de 12,13-diHOME aumentaron inmediatamente después del ejercicio y volvieron a la línea base 1 hora después.
Para identificar el tejido de origen de esta lipocina, se realizó un estudio en ratones sometidos a ejercicio físico. Los resultados mostraron niveles plasmáticos significativamente más bajos de 12,13-diHOME en animales a los que se les había extirpado el BAT inguinal mediante cirugía en comparación con los animales cuyo BAT se mantuvo intacto, lo que demuestra que esta lipocina es una batocina liberada por el BAT en respuesta al ejercicio.
Las batocinas son factores de secreción liberados por el BAT, que pueden ser proteínas, lípidos o miARNs. Han sido descritos recientemente en la literatura, y sus funciones incluyen acciones autocrinas, paracrinas y sistémicas, contribuyendo al aumento del gasto energético y la homeostasis de la glucosa, considerados aliados en la lucha contra la obesidad y enfermedades asociadas.
La identificación de las batokinas en la ciencia es un descubrimiento reciente, y los factores que estimulan su secreción aún se encuentran bajo investigación. Algunos estímulos identificados en la literatura capaces de inducir la secreción de batokinas incluyen la exposición al frío, la activación b-adrenérgica, la ingesta de nutracéuticos como los capsinoides y niveles elevados de hormonas tiroideas. Aunque 12,13-diHOME es la única batokina con evidencia de ser secretada en respuesta al ejercicio físico en un entorno in vivo, algunos estudios in vitro sugieren que la irisina y el lactato, factores liberados por el músculo esquelético en respuesta al ejercicio físico y con acciones en el “browning” de WAT, también estimulan la secreción de batokinas.
Se realizó un estudio con precursores de adipocitos subcutáneos y de la región del cuello en humanos, regiones anatómicas donde se pueden desarrollar o encontrarse adipocitos con firmas genéticas beige, para evaluar el efecto de la irisina, una miokina secretada en respuesta al ejercicio físico, en la diferenciación a adipocitos termogénicos y el secretoma producido. En los resultados, no fue posible observar un aumento en la expresión de genes termogénicos; sin embargo, durante la diferenciación de adipocitos, hubo una secreción significativa de la quimioquina ligando 1 (CXCL1), una batokina con funciones angiogénicas, lo que sugiere que la irisina tiene un papel regulador en la función secretora del tejido adiposo termogénico.
Jeanson et al. llevaron a cabo un estudio in vitro para investigar los efectos del lactato en adipocitos maduros diferenciados a partir de la fracción estromal vascular de WAT en animales. Además de observar un aumento en la expresión de UCP-1, un efecto bien conocido del lactato en el “browning” de WAT, el estudio también reveló un aumento rápido en la expresión y secreción del factor de crecimiento de fibroblastos 21 (FGF21), una batokina con acciones tanto autocrinas como sistémicas. Este aumento en el FGF21 se encontró que era mediado a través de la señalización de la proteína quinasa activada por mitógenos p38 (p38-MAPK), una clase de proteínas activadas asociadas con el estrés celular e involucradas en procesos de diferenciación celular. Además del lactato, este estudio sugirió que otros metabolitos del ejercicio, como el piruvato y los cuerpos cetónicos, pueden promover el mismo efecto.
Principalmente, el hígado secreta la proteína FGF21; sin embargo, evidencia emergente sugiere que también es secretada por el músculo esquelético, WAT y BAT, clasificándola como una batocina. Al igual que otras batocinas, se ha asociado con efectos metabólicos positivos en varios tejidos diana, como el hígado, el sistema nervioso central y el tejido adiposo, contribuyendo de manera sistémica a la regulación de la energía y la homeostasis de la glucosa a través de acciones como el aumento de la oxidación de glucosa y la termogénesis por BAT, estimulando la oxidación de ácidos grasos hepáticos y actuando en el hipotálamo para reducir el consumo de azúcar.
La evidencia anterior sugiere que el ejercicio físico puede modular la actividad secretora de los tejidos termogénicos, potencialmente proporcionando beneficios adicionales para la salud metabólica al estimular la secreción de batocinas. Aunque los estudios en esta área son prometedores, aún se requieren avances adicionales para validar las hipótesis planteadas en el entorno in vivo. Además, se necesitan evaluaciones integrales para investigar el comportamiento de las miocinas y los metabolitos liberados en respuesta al ejercicio sobre la función secretora de los tejidos termogénicos, considerando la complejidad intrincada del organismo.
REMODELACIÓN DEL TEJIDO ADIPOSO POR EL EJERCICIO FÍSICO
La remodelación del tejido adiposo en la obesidad está relacionada con la hipertrofia de los adipocitos, la baja vascularización del tejido y el perfil proinflamatorio de las células del sistema inmunológico, lo que confiere disfuncionalidad al tejido adiposo observada en el fenotipo de la obesidad. Por otro lado, la remodelación que la práctica de ejercicio físico puede proporcionar se refiere a alteraciones en la morfología de los adipocitos, con menor contenido de lípidos, mayor contenido de mitocondrias, mayor vascularización y células del sistema inmunológico con un perfil predominantemente antiinflamatorio, lo que proporciona un microambiente favorable para la activación de los adipocitos beige.
La actividad del BAT y el fenotipo beige en el WAT son mantenidos por la estimulación nerviosa del sistema nervioso central, por lo que el desarrollo de la inervación simpática en estos tejidos es crucial para la funcionalidad del tejido termogénico.
Varios estudios han identificado que la actividad del sistema nervioso central y los niveles de catecolaminas aumentan durante el ejercicio físico, promoviendo acciones en el tejido adiposo blanco, como el “browning” de los adipocitos blancos y estimulando la lipólisis de los triglicéridos a través de la unión a los receptores β-adrenérgicos de los adipocitos.
En un estudio reciente en animales, se observó que el ejercicio físico moderado promovía un aumento en el contenido de receptores β-3-adrenérgicos y la actividad simpática en el BAT. Sin embargo, el papel del ejercicio físico en promover el crecimiento de la inervación simpática en el tejido adiposo humano aún no está claro, ya que no se han realizado estudios directos sobre este tema en la literatura.
Además de la inervación simpática, se requiere una perfusión adecuada del tejido para mantener la actividad metabólica del tejido termogénico al proporcionar oxígeno y sustratos energéticos. A diferencia de los resultados relacionados con el crecimiento de los nervios simpáticos, hay evidencia consistente en la literatura sobre la angiogénesis promovida por el ejercicio físico en el tejido adiposo. Se ha observado que el ejercicio físico es capaz de revertir la disfuncionalidad del WAT causada por la obesidad inducida por la dieta en ratas, aumentando la densidad capilar y la expresión de macrófagos tipo 2 a niveles incluso más altos que los de animales con una dieta control.
La polarización de los macrófagos de tipo 1 (M1) a tipo 2 (M2) en el tejido adiposo también parece ser un factor que influye en la capacidad del WAT para adquirir un fenotipo beige. Varios estudios han observado este resultado en respuesta al ejercicio. En varios estudios en humanos, tanto el ejercicio aeróbico como el de fuerza han demostrado un potencial angiogénico significativo en individuos con resistencia a la insulina e hipertensión, así como en individuos sanos. Este efecto parece estar asociado con un aumento en la capacidad angiogénica de las células progenitoras endoteliales. El mismo efecto ya se ha observado en el BAT de animales.
Además, el ejercicio físico parece ser un factor significativo que contribuye a la expansión saludable del tejido adiposo blanco en situaciones de exceso calórico crónico. Este hallazgo se puede atribuir a la promoción de la angiogénesis y la biogénesis mitocondrial, al tiempo que se evita la hipertrofia de los adipocitos, lo que hace que el tejido sea disfuncional y esté asociado con una inflamación crónica de bajo grado, resistencia a la insulina, diabetes tipo 2 y otros trastornos metabólicos.
Al igual que el ejercicio físico, las acciones autocrinas y paracrinas de las batocinas también ejercen el efecto de remodelar el tejido adiposo termogénico para promover un entorno que favorezca su mayor activación y, en consecuencia, optimice sus funciones termogénicas y secretoras. Estas acciones se discutirán en el siguiente tema.
Aprende todos los meses con nuestra suscripción
BATOKINAS Y REMODELACIÓN DEL TEJIDO ADIPOSO
Como se ha descrito previamente, para que ocurra la termogénesis en BAT, se requiere no solo la actividad de los adipocitos termogénicos maduros positivos para UCP-1, sino también el suministro adecuado de sangre al tejido. Este suministro sanguíneo permite la llegada de sustratos energéticos y oxígeno esenciales para mantener eficientemente la termogénesis.
Otros factores cruciales para la termogénesis en BAT y la “browning” del tejido adiposo blanco (WAT) involucran la inervación simpática del tejido y la presencia de células del sistema inmunológico que residen en el tejido y pueden influir en su funcionalidad dependiendo de su fenotipo.
En este contexto, las acciones de las batocinas autocrinas y paracrinas están dirigidas hacia las células endoteliales, neuronales o del sistema inmunológico dentro del tejido termogénico, estimulando el crecimiento de nervios periféricos, la angiogénesis y la modulación de las células inmunológicas residentes, optimizando su actividad termogénica y, por esta razón, son importantes objetivos terapéuticos para la restauración de BAT en humanos que han perdido o tienen cantidades insignificantes de este tejido, como las personas obesas o de edad avanzada.
Efectos de la Batocina en el Crecimiento de Neuritas
Algunas proteínas, como NGF y NRG4, estimulan el crecimiento de neuritas (una neurita o proceso neuronal se refiere a cualquier proyección del soma de una neurona, ya sea una dendrita o un axón), promoviendo el crecimiento y la diferenciación de neuronas simpáticas en el tejido. Estas proteínas se consideran marcadores importantes de BAT, con una función reguladora en la inervación simpática de BAT en respuesta al frío. Los niveles séricos de NRG4 disminuyen en condiciones patológicas como la diabetes tipo 2, el síndrome metabólico y la enfermedad de las arterias coronarias en humanos.
Efectos Angiogénicos de las Batocinas.
Además de promover la inervación simpática, BAT también secreta batocinas con capacidades angiogénicas, como el VEGFA. La proteína VEGFA promueve la activación, proliferación y diferenciación de las células endoteliales vasculares, actuando como un desencadenante de la angiogénesis en el tejido adiposo.
Park et al. observaron además que el VEGFA inducía significativamente la “browning” de los adipocitos blancos. En el mismo estudio, la trasplantación de tejido adiposo con una alta expresión de VEGFA en ratones con obesidad inducida por la dieta resultó en una notable disminución de la respuesta inflamatoria.
Otros estudios también observaron la acción del VEGFA en la promoción de la “browning” del tejido adiposo, aumentando la expresión de UCP-1 y PGC-1α en este tejido. Además, el VEGFA puede promover la angiogénesis en el propio BAT, estimulando su activación.
BMP8b pertenece a la familia de proteínas morfogenéticas óseas y es secretada por los adipocitos marrones maduros en respuesta a la activación β-adrenérgica u otros estímulos no adrenérgicos, como el estrógeno. Parece desempeñar un doble papel: primero, en la promoción de la vascularización del tejido al estimular factores angiogénicos, y segundo, promoviendo indirectamente la inervación del tejido al estimular la producción endógena de NRG4.
EFECTOS DE LAS BATOKINAS EN LA INMUNOMODULACIÓN
El perfil de citocinas y las células del sistema inmunológico que residen en el tejido adiposo parecen interferir con su funcionalidad. En la obesidad, la infiltración de citocinas inflamatorias en BAT parece perjudicar la activación de la termogénesis, afectando negativamente su funcionalidad, lo que confiere cierta similitud entre BAT y WAT.
Una quimioquina de la familia CXC, CXCL14, se identificó como una batocina capaz de reclutar macrófagos M2 al propio BAT, modulando el fenotipo inflamatorio. Como demostró Cereijo et al., la CXCL14 secretada por BAT, además de activarla, también promovió la “browning” de WAT, lo que refleja una mejora en la homeostasis de la glucosa en ratones con obesidad inducida por la dieta.
Otros factores de secreción de BAT, como METRNL y la adiponectina, también parecen modular el perfil de los macrófagos residentes en el tejido a través de diferentes mecanismos de acción, favoreciendo un perfil antiinflamatorio y estimulando la diferenciación de adipocitos blancos en beige.
El factor de diferenciación de crecimiento 15 (GDF15), otra batocina que modula el fenotipo inflamatorio local, es secretado por BAT en respuesta a la exposición al frío y puede suprimir la expresión de genes proinflamatorios en el tejido.
Por último, y posiblemente más importante, la IL-6 también se reconoce como una batocina, quizás la más estudiada. Una de sus acciones ocurre localmente como consecuencia de la activación de BAT en respuesta a un estímulo β-adrenérgico, actuando también en el reclutamiento de macrófagos M2 y promoviendo la modulación del perfil de las células inmunológicas en el tejido, lo que impacta directamente en su capacidad de activación.
EFECTOS TERMOGÉNICOS DE LAS BATOKINAS
Aunque la termogénesis en el tejido adiposo puede ser controlada por la activación β-adrenérgica, la influencia de las batocinas parece ser capaz de promover este fenómeno de manera independiente a este estímulo.
La proteína señalizadora del tejido adiposo recientemente descubierta, batocina (Adissp), altamente expresada en BAT, parece unirse a receptores específicos en el adipocito de manera paracrina, activando la vía PKA y promoviendo la transcripción de genes glucolíticos y termogénicos en condiciones termoneutrales y de manera independiente de los receptores β-3-adrenérgicos. Estos cambios en la expresión génica se acompañaron de mejoras en la homeostasis de la glucosa.
Estos datos sugieren que la secreción de batocinas puede ser una alternativa a la exposición al frío o a los agonistas β-adrenérgicos para promover la “browning” de los adipocitos y su actividad termogénica.
Los datos sobre los efectos del ejercicio físico y las batocinas autocrinas/paracrinas señalan una similitud en sus roles en la remodelación del tejido adiposo, contribuyendo así a su funcionalidad.
El tejido adiposo disfuncional se asocia al desarrollo de enfermedades metabólicas, despertando un gran interés en la investigación de factores que desencadenen la secreción de batocinas, ya que sus efectos locales dentro del tejido adiposo se asemejan a los efectos del ejercicio físico, potencialmente influyendo en la remodelación y funcionalidad del tejido.
RETOS Y PERSPECTIVAS FUTURAS
A pesar de que se ha demostrado la relevancia de la activación de BAT, todavía existen varias lagunas que deben abordarse en este campo de investigación. Esto incluye la exploración de diferentes vías que impulsan la activación de BAT y la búsqueda de nuevos enfoques para estimular este tejido de manera efectiva, sostenible y segura. La comunidad científica está explorando activamente este tema. Algunos estudios en animales han demostrado el papel de los metabolitos de la microbiota en la inducción de la termogénesis de BAT, mientras que otros han observado el potencial de algunas hormonas tiroideas y nutracéuticos. Sin embargo, la evidencia todavía se limita a modelos in vitro y animales. El progreso en esta área científica depende de la investigación con sujetos humanos y del esfuerzo por observar si estos nuevos enfoques para activar BAT estarán acompañados de efectos clínicamente relevantes. Estos esfuerzos deberían ser el enfoque central de futuros estudios, incluyendo más investigación clínica para fortalecer el papel del ejercicio físico en la activación de BAT, con el objetivo de recopilar estudios comparables en una revisión sistemática para obtener una estimación sólida de sus efectos.
Una preocupación importante a considerar al evaluar los impactos en la salud metabólica de la activación de BAT es la duración limitada de sus efectos. Se ha sugerido que la interrupción de la exposición a estímulos externos puede reducir la activación de BAT. Esta disminución es más pronunciada en individuos obesos, mientras que los sujetos delgados pueden mantener una mayor producción de calor después de 1 hora de recalentamiento. De manera similar, los niveles de 12,13-diHOME secretados por BAT en respuesta al ejercicio volvieron a la línea de base después de 1 hora. Después de 3 horas, los niveles permanecieron elevados solo en individuos jóvenes y activos en comparación con individuos mayores y sedentarios. La información sobre cuánto tiempo el ejercicio físico podría mantener la función termogénica o secretora de la actividad de BAT todavía necesita ser explorada en profundidad en la literatura. Sería valioso determinar el volumen y la frecuencia óptimos de esta intervención para lograr los resultados deseados. Además, es importante investigar si hay diferencias en los efectos del ejercicio en diversas poblaciones. Además, es relevante destacar la complejidad de la obesidad y sus enfermedades asociadas. Dada su naturaleza multifacética, la activación de BAT puede complementar otras intervenciones para contrarrestar la obesidad en lugar de ser utilizada como una estrategia independiente. Además, una limitación importante en la aplicabilidad del aumento del gasto energético a través de la activación de BAT para promover un déficit calórico y el control del peso es la posibilidad de desencadenar mecanismos adaptativos para restaurar la homeostasis y preservar el tejido graso.
Otra limitación en el estudio de BAT es la falta de herramientas y métodos adecuados para su cuantificación. Aunque la FDG-PET/TC se utiliza comúnmente para detectar BAT en la investigación científica, se basa en la actividad de la oxidación de la glucosa, lo que potencialmente lleva a subestimar la masa total de BAT, ya que también puede oxidizar otros sustratos. Además, las herramientas actualmente disponibles para identificar los adipocitos beige en el WAT, como las biopsias, presentan desafíos debido a su alto costo y naturaleza invasiva. Avanzar en los esfuerzos de investigación para explorar métodos más accesibles para detectar y cuantificar estos tejidos, como biomarcadores sanguíneos, sería un avance significativo en este campo.
En cuanto a las batocinas, la ciencia todavía tiene mucho trabajo por delante para llenar las muchas lagunas en este tema. Es crucial elucidar si BAT es la fuente de 12,13-diHOME secretada en respuesta al ejercicio en humanos y qué otras batocinas son estimuladas por el ejercicio físico o sus miocinas asociadas. Además, técnicas modernas como la metabolómica y la proteómica pueden ser útiles en futuras investigaciones para determinar los niveles circulantes de batocinas y establecer más asociaciones entre su liberación y la remodelación del tejido adiposo y las mejoras en la salud metabólica.
CONCLUSIONES
Los datos recopilados en esta revisión sugieren que el ejercicio físico y sus miocinas liberadas tienen un gran potencial para estimular la funcionalidad del tejido adiposo marrón y beige, ya sea la función termogénica o la función secretora que implica la liberación de batocinas. Dada la evidencia presentada en esta revisión, es factible sugerir que los efectos de las batocinas autocrinas y paracrinas son comparables a los del ejercicio físico en el tejido adiposo blanco. Estas batocinas tienen el potencial de remodelar el tejido, llevando a un fenotipo inversamente asociado con enfermedades metabólicas y promoviendo un microambiente favorable para la formación de adipocitos beige, un enfoque prometedor para restaurar el tejido termogénico en poblaciones con cantidades bajas o insignificantes, que se beneficiarían de su reactivación, como las personas con obesidad. Sin embargo, nuestro conocimiento completo sobre las batocinas secretadas y sus efectos se basa en evidencia preclínica y aún está lejos de ser exhaustivo. No obstante, las ideas abordadas por los datos actualmente disponibles indican que futuras investigaciones y estudios en esta área tienen un gran potencial para posibles aplicaciones terapéuticas en el futuro.
Acceso libre al artículo original en: https://www.fisiologiadelejercicio.com/wp-content/uploads/2023/11/Physical-activity-and-batokines.pdf
Referencia completa: Ortiz GU, de Freitas EC. Physical activity and batokines. Am J Physiol Endocrinol Metab. 2023 Nov 1;325(5):E610-E620. doi: 10.1152/ajpendo.00160.2023.